
|
| |
 |
曾振圓 助理教授 Dr. Chen Yuan Tseng BACK |
| |
國防醫學院 博士
chenyuan1102@dragon.nchu.edu.tw
辦公室電話: 04-22840485#255
實驗室電話: 04-22840485#256
實驗室網址: Under construction
ORCID
|
 |
簡要經歷 |
|
| |
2018/08-2022/07 New York University, School of Medicine, Department of Biochemistry & Molecular Pharmacology (Postdoctoral fellow).
2017/08-2018/07 NIH, National Cancer Institute (Visiting fellow).
2015/02-2016/07 Academia Sinica, Institute of Cellular and Organismic Biology (Postdoctoral fellow).
2010/09-2015/01 National Defense Medical Center, Graduate Institute of Life Sciences (Ph.D.)
|
 |
研究方向 |
|
| |
幹細胞(Stem cell)是具有自我更新(Self-renewal)及分化(Differentiation)能力的特殊細胞,對於器官發育與修復至關重要。
幹細胞位於特化的微環境稱為Niche。Niche會與幹細胞相互結合並提供短距離自我更新因子(Short-range self-renewal factors)維持幹細胞的特性。然而Niche提供的空間與更新因子資源是有限的,
這導致幹細胞之間為了在Niche中獲得資源,相互競爭。然而幹細胞如何競爭(Stem cell competition)至今仍未清楚。特別當生殖幹細胞之間的競爭(Germline stem cell competition),其輸贏的結果將會下一代的基因的遺傳方向。
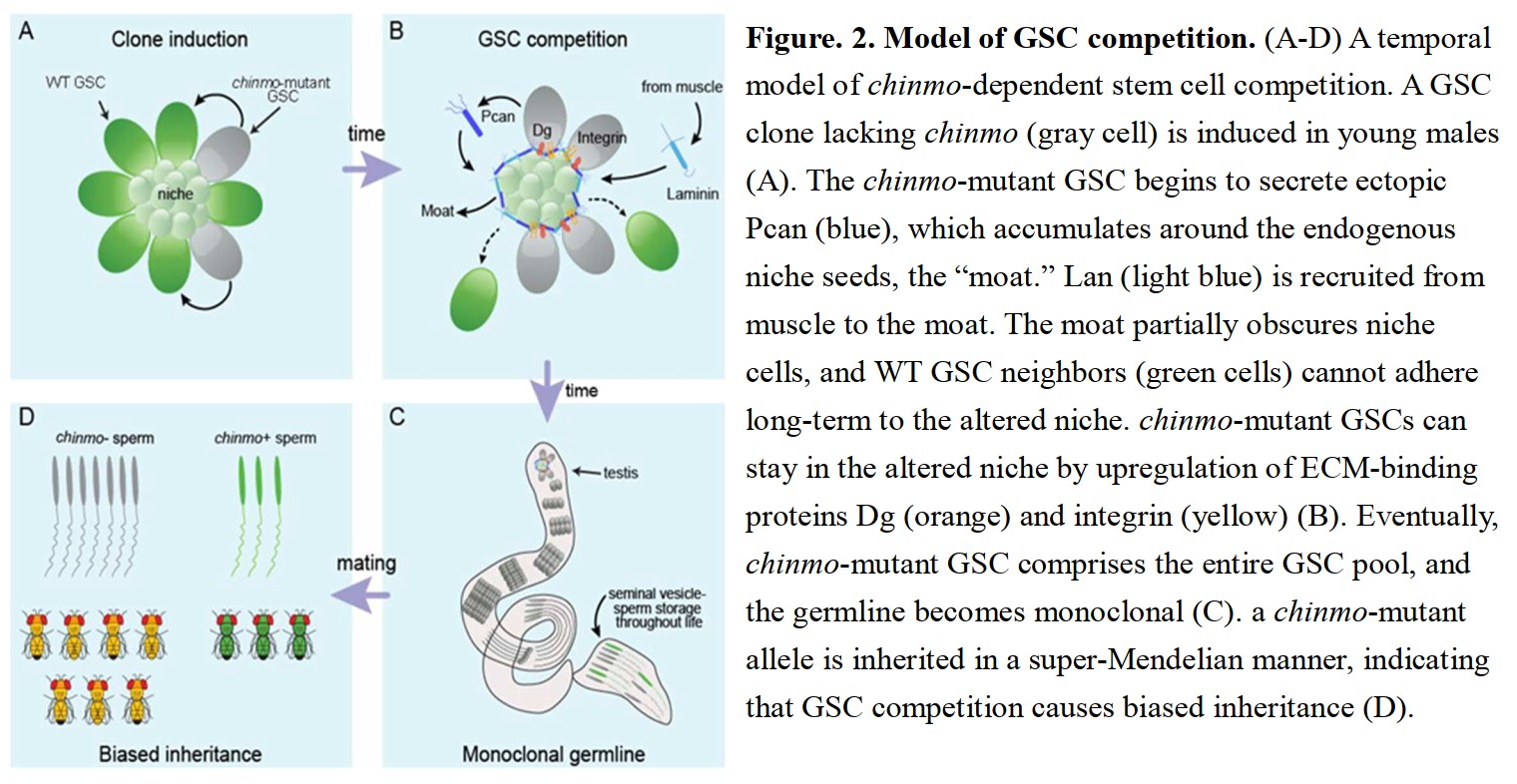
為了瞭解生殖幹細胞競爭機制,我們實驗室主要以公果蠅睪丸(Drosophila melanogaster testes)中的精子生殖幹細胞作為模式生殖幹細胞,探討其競爭分子機制(Fig.1)。

我們的研究發現,在正常果蠅睪丸8-12顆的GSCs (WT GSCs)中,產生一顆帶有Chronical inappropriate morphogenesis (chinmo)基因純合突變(Homozygous mutation, chinmo-/- GSCs) 會誘發生殖幹細胞競爭。
已知Chinmo的蛋白功能為轉錄抑制因子(transcriptional repressor )並且會表現於生殖幹細胞中,然而其盼演角色在我們的研究之前仍然尚未清楚。經實驗發現chinmo-/- GSCs會排擠周遭正常的生殖幹細胞(WT neighbor GSCs)
並誘發其離開niche(Green cells, Figure.2B),最終整個睪丸只剩下chinmo-/- GSCs與其分化後的精子細胞(Black cells. Figure.2C,D)。詳細競爭機轉請參考圖示說明(Fig.2)。
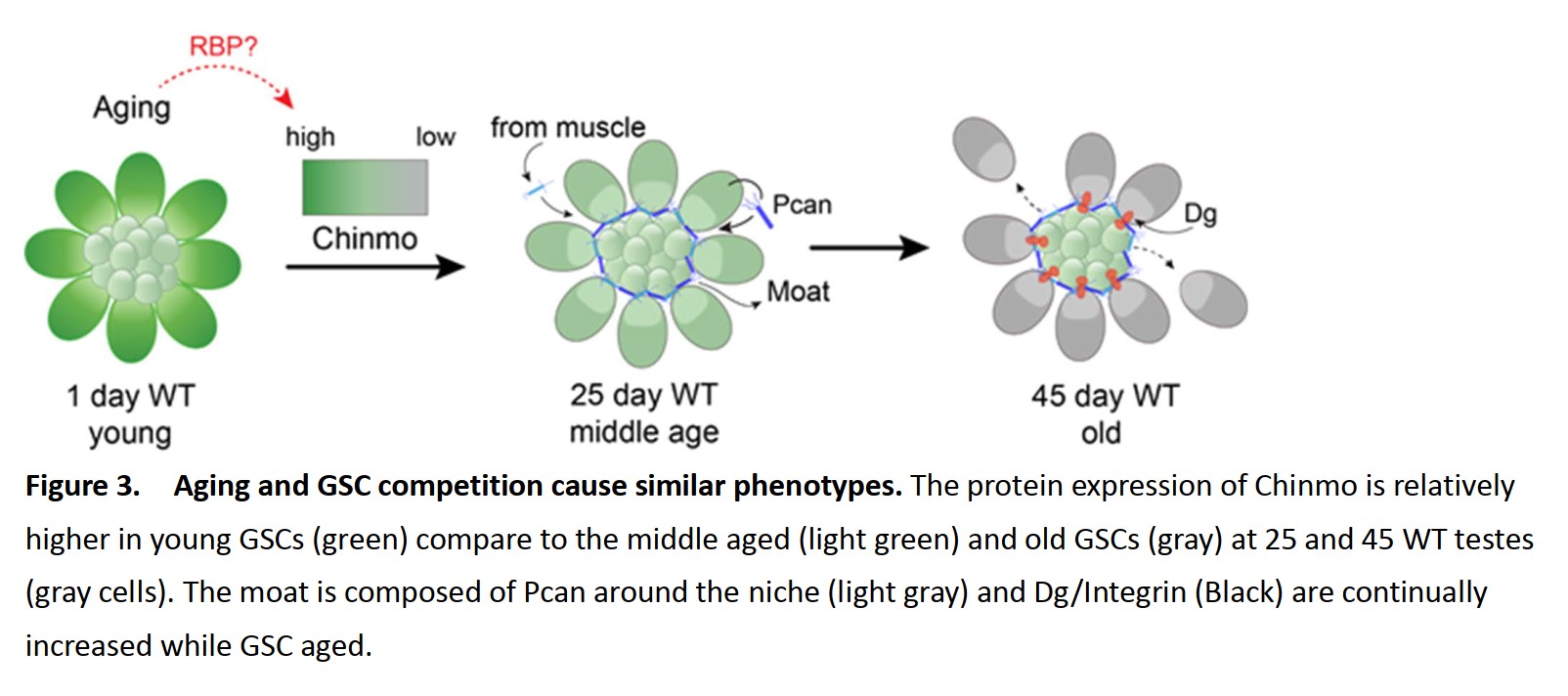
更進一步,我們也發現chinmo-mediated GSC competition機制會發生在老化GSCs中(Fig.3); 帶有較低chinmo蛋白表現的GSCs,可以透過競爭機制而留下。過去已知老化的過程中會導致幹細胞在體內快速的流失,然而機制尚未清楚。
我們的研究結果認為老化會透過引發生殖幹細胞競爭,使得競爭力較弱的生殖幹細胞離開niche。
本實驗室將根據此研究結果基礎之下,分成三個研究主題(1)尋找chinmo 轉錄因子其下游目標基因。(2)尋找生殖幹細胞chinmo的上游因子。(3)了解老化及幹細胞競爭之連結關係。
研究主題
- 找出chinmo下游轉錄目標基因。
由於Chinmo蛋白具有BTB domain與zinc-finger domain,目前已知其功能為轉錄抑制因子(Transcriptional repressor),然而其下游的目標基因仍不清楚。我們未來會使用免疫染色體沉澱(Chromatin immunoprecipitation, ChiP)
的方法尋找chinmo的轉錄目標(transcriptional targets),並測試其目標基因是否對於幹細胞競爭扮演角色。
- 探討生殖幹細胞chinmo表現是如何被老化所調控。
Chinmo 蛋白隨著生殖幹細胞(GSCs)的老化, 其表現量會有明顯的下降,且老化的睪丸其niche周圍也會累績大量的胞外基質 (Extracellular matrix, ECM) (Blue ring, Fig.3) ,
使得生殖幹細胞數量的下降。只要我們去提高chinmo在老化GSC中的表現,發現以上所提到的phenotype都可以被恢復,這說明老化會藉由調控chinmo的表現量來引發幹細胞競爭機制發生,
進而影響部分GSCs對於niche結合的能力,最後導致GSC數量的下降(Fig.3)[1]。因此chinmo如何被精準的調控對於幹細胞的數量與活性將是重要決定性關鍵之一。過去已知RNA-binding proteins (RBPs)會參與mRNA調控並影響基因與蛋白的表現,
我們將會透過已知RBPs 會結合mRNA共有序列 (consensus sequence)預測可能會與chinmo mRNA結合的RBPs,接著利用螢光染色與RNAi knockdown方式尋找可能與chinmo mRNA結合的RBPs。
- 找出老化與幹細胞競爭之相互分子連結關係。
承上第二個研究方向,我們發現chinmo-/- GSCs或是老化GSCs使用同樣的競爭機制去改變Niche環境,進而導致帶有較低Chinmo蛋白表現的GSC留在老化的Niche (Fig.3)。
這研究說明了,隨著果蠅老化,生殖幹細胞之間會利用競爭機制決定去留。因此,我們認為最後留下的生殖幹細胞是具有高度競爭力。為了瞭解除了Chinmo之外,是否有其他基因參與老化引發的幹細胞競爭,
我們未來將利用Flow cytometry分離出帶有螢光年輕與老化的GSCs ,並使用Single-cell RNA sequencing分析其基因表現差異性。我們將會探討受到老化影響的基因與幹細胞競爭連結關係。
果蠅與人類之間基因組(Genome)約有60%的同源性(Homologs),之中約七成同源性基因與人類相關疾病基因(Disease-associated genes)相關。我們希望透過這三種不同的研究方向,有系統性的了解生殖幹細胞的競爭與老化之分子機制,
若能更了其老化與幹細胞競爭之連結,也許可以延緩老化引起的幹細胞流失。
此外,老化透過幹細胞競爭機制選擇性的留下帶有較高競爭能力的生殖幹細胞(Selection bias),並導致帶有其分化後的精子也被選擇性遺傳至子代。
已知老化父系生殖幹細胞與精子細胞經常性帶有DNA突變(Paternal-age-related de novo mutation),並且引發生殖幹細胞競爭,其中有部分突變會顯著性遺傳給子代導致神經相關特化疾病(Genetics of hereditary neurological disorders)。
因此,我們希望未來可以利用老化果蠅作為疾病模式物種,透過對公果蠅生殖幹細胞基礎研究,了解老化成年男性與其子代遺傳疾病相關性與致病原因(Paternal age effect disorder)。
在參與實驗室訓練過程中,你將學會(1)果蠅遺傳學與發育生物學,(2)幹細胞與老化生物學,(3) 基礎的生物資訊分析與分子生物學技術。
實驗室剛開始建立,我們歡迎對於幹細胞科學與基礎科學有興趣,想出國念書做為生涯規劃的同學透過e-mail與我聯絡。
參考文獻:
Tseng, C.Y. et al., chinmo-mutant spermatogonial stem cells cause mitotic drive by evicting non-mutant neighbors from the niche. Dev Cell, 2022. 57(1): p. 80-94 e7.
|
 |
近期著作 |
|
| |
| A. |
期刊論文 |
|
- Hsu LS, Tseng CY. (2010) Zebrafish calcium/calmodulin-dependent protein kinase II (cam-kii) inhibitors: expression patterns and their roles in zebrafish brain development. Dev Dyn. 239(11):3098-105. PMID: 20925123.
- Hsu LS, Liang CJ, Tseng CY, Yeh CW, Tsai JN. (2011) Zebrafish cyclin-dependent protein kinase-like 1 (zcdkl1): identification and functional characterization. Int J Mol Sci. 12(6):3606-17. PMID: 21747697.
- Yang SA, Wang WD, Chen CT, Tseng CY, Chen YN, Hsu HJ. (2013) FOXO/Fringe is necessary for maintenance of the germline stem cell niche in response to insulin insufficiency. Dev Biol. 382(1):124-35. PubMed PMID: 23895933.
- Kao SH, Tseng CY, Wan CL, Su YH, Hsieh CC, Pi H, Hsu HJ. (2015) Aging and insulin signaling differentially control normal and tumorous germline stem cells. Aging Cell. 14(1):25-34. PMID: 25470527
- Tseng CY, Kao SH, Wan CL, Cho Y, Tung SY, Hsu HJ. (2014) Notch signaling mediates the age-associated decrease in adhesion of germline stem cells to the niche. PLoS Genet. 18;10(12):e1004888. PMID: 25521289.
- Tseng CY, Kao SH, Hsu HJ. (2016) Snail controls proliferation of Drosophila ovarian epithelial follicle stem cells, independently of E-cadherin. Dev Biol. 15;414(2):142-8. PMID: 27141871.
- Tseng CY, Hsu HJ. (2017) Decreased expression of lethal giant larvae causes ovarian follicle cell outgrowth in the Drosophila Scutoid mutant. PLoS One. 12(12):e0188917. PMID: 29261681
- Tseng CY, Su YH, Yang SM, Lin KY, Lai CM, Rastegari E, Amartuvshin O, Cho Y, Cai Y, Hsu HJ. Smad-independent BMP signaling in somatic cells limits the size of the germline stem cell pool. (2018) Stem Cell Reports. 11(3):811-827. PMID: 30122445.
- Tseng CY, Burel M, Cammer M, Harsh S, Flaherty M, Baumgartner S and Bach E. chinmo-mutant spermatogonial stem cells cause mitotic drive by evicting non-mutant neighbors from the niche (2022) Dev Cell 57(1): 80-94.PMID:34942115.
|
| B. |
專利Patents |
| |
| 類別
|
專利名稱
Title of patent |
國別
Country
|
專利號碼
Patent number |
發明人
Inventor |
專利權人
Patent holder |
專利期間 |
科技部計畫編號 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| C. |
研討會論文 |
|
|
| D. |
技術報告及其他 Sequences submitted to GenBank |
| |
|
| E. |
專書及特刊: |
| |
|
| 計畫 |
|
|
 |
榮 譽 |
|
|
- 2009 Honorary Member of Phi-Tau-Phi Scholastic Honor Society of R.O.C.
- 2015 Thesis Award, Tang-der Lee Biomedical Foundation
- 2019-2021 NYSTEM postdoctoral fellowship
|
 |
授課課程 |
|
| |
- 高等分子生物學(研究所)
- 分子生物學技術
- 專題討論
- 文獻研討
- 分子生物學(研究所)
- 基礎幹細胞生物學
- 高等分子遺傳學
- 生命的動力與延續
|
|
|
|
|